普通口服固體制劑溶出度試驗
技術指導原則
一、前言
本指導原則適用于普通口服固體制劑,包括以下內容:(1)溶出度試驗的一般要求;(2)根據生物藥劑學特性建立溶出度標準的方法;(3)溶出曲線比較的統計學方法;(4)體內生物等效性試驗豁免(即采用體外溶出度試驗代替體內生物等效性試驗)的一般考慮。
本指導原則還針對藥品的處方工藝在批準后發生變更時,如何通過溶出度試驗確認藥品質量和療效的一致性提出了建議。附錄對溶出度試驗的方法學、儀器和操作條件進行了概述。
二、背景
固體制劑口服給藥后,藥物的吸收取決于藥物從制劑中的溶出或釋放、藥物在生理條件下的溶解以及在胃腸道的滲透。由于藥物的溶出和溶解對吸收具有重要影響,因此,體外溶出度試驗有可能預測其體內行為。基于上述考慮,建立普通口服固體制劑(如片劑和膠囊)體外溶出度試驗方法,有下列作用:
1.評價藥品批間質量的一致性;
2.指導新制劑的研發;
3.在藥品發生某些變更后(如處方、生產工藝、生產場所變更和生產工藝放大),確認藥品質量和療效的一致性。
在藥品批準過程中確定溶出度標準時,應考慮到藥物的溶解性、滲透性、溶出行為及藥代動力學特性等因素,以保證藥品批間質量的一致性、變更以及工藝放大前后藥品質量的一致性。
對于新藥申請,應提供關鍵臨床試驗和/或生物利用度試驗用樣品以及其他人體試驗用樣品的體外溶出度數據。對于仿制藥申請,應在溶出曲線研究的基礎上制定溶出度標準。無論是新藥還是仿制藥申請,均應根據可接受的臨床試驗用樣品、生物利用度和/或生物等效性試驗用樣品的溶出度結果,制定溶出度標準。
三、生物藥劑學分類系統
根據藥物的溶解性和滲透性,推薦以下生物藥劑學分類系統(BCS)(Amidon 1995):
1類:高溶解性–高滲透性藥物
2類:低溶解性–高滲透性藥物
3類:高溶解性–低滲透性藥物
4類:低溶解性–低滲透性藥物
上述分類原則可作為制定體外溶出度質量標準的依據,也可用于預測能否建立良好的體內-體外相關性(IVIVC)。在37±1℃下,測定**高劑量單位的藥物在250mL pH值介于1.0和8.0之間的溶出介質中的濃度,當藥物的**高劑量除以以上介質中的藥物濃度小于或等于250mL時,可認為是高溶解性藥物。一般情#p#分頁標題#e#況下,在胃腸道內穩定且吸收程度高于85%或有證據表明其良好滲透性的藥物,可認為是高滲透性藥物。
在禁食狀態下,胃內滯留(排空)T50%時間為15∼20分鐘。對于高溶解性-高滲透性(1類)及某些情況下的高溶解性-低滲透性(3類)藥物制劑,以0.1mol/L HCl為介質,在適當的溶出度試驗條件下,15 分鐘的溶出度大于85%時,可認為藥物制劑的生物利用度不受溶出行為的限制,即制劑的行為與溶液相似。在這種情況下,胃排空速度是藥物吸收的限速步驟。如果藥物制劑溶出比胃排空時間慢,建議在多種介質中測定溶出曲線。
對于低溶解性-高滲透性藥物(2類),溶出是藥物吸收的限速步驟,有可能建立較好的體內外相關性。對于此類制劑,建議在多種介質中測定溶出曲線。
對于高溶解性-低滲透性藥物(3類),滲透是藥物吸收的限速步驟,可能不具有好的體內外相關性,吸收程度取決于溶出速率與腸轉運速率之比。
對于低溶解性-低滲透性藥物(4類),制備口服制劑比較困難。
四、溶出度標準的建立
建立體外溶出度標準的目的是保證藥品批間質量的一致性,并提示可能的體內生物利用度問題。對于新藥申請,應根據可接受的臨床試驗樣品、關鍵生物利用度試驗和/或生物等效性試驗用樣品的溶出數據以及藥品研發過程中的經驗,確定溶出度標準。如果穩定性研究批次、關鍵臨床試驗批次及擬上市的樣品生物等效,也可根據穩定性研究用樣品的數據制定溶出度標準。
對于仿制藥申請,應根據可接受的生物等效性試驗用樣品的溶出數據,確定溶出度標準。一般仿制藥的溶出度標準應與參比制劑一致。如果仿制藥的溶出度與參比制劑存在本質差異,但證明體內生物等效后,該仿制藥也可建立不同于參比制劑的溶出度標準。建立了藥品的溶出度標準后,藥品在有效期內均應符合該標準。
普通口服固體制劑可采用下列兩種溶出度控制方法:
1.單點檢測
可作為常規的質量控制方法,適用于快速溶出的高溶解性藥物制劑。
2. 兩點或多點檢測
(1)可反映制劑的溶出特征。
(2)作為某些類型藥物制劑的常規質量控制檢驗(如卡馬西平等水溶性差且緩慢溶解的藥物制劑)。
采用兩點或多點溶出度檢測法,能更好地反映制劑的特點,有助于質量控制。
(一)新化合物制劑溶出度標準的建立
考察藥物制劑的溶出度特征應考慮藥物的pH-溶解度曲線及pKa,同時,測定藥物的滲透性或辛醇/水分配系數可能有助于溶出方法的選擇和建立。應采用關鍵臨床試驗和/或生物利用度試驗用樣品的溶出度數據作為制定溶出度標準的依據。如果擬上市樣品與關鍵臨床試驗中所用樣品處方存在顯著差異,應比較兩種處方的溶出曲線并進行生物等效性試驗。
應在適當、溫和的試驗條件下進行溶出度試驗,比如籃法50∼100 轉/分鐘或槳法50∼75轉/分鐘,取樣間隔15分鐘,獲得藥品的溶出曲線,并在此基礎上制定溶出度標準。對于快速溶出的藥物制劑,可能需要以10分鐘或更短的間隔期取樣,以繪制獲得完整的溶出曲線。對于高溶解性(BCS 1類和3類)和快速溶出的藥物制劑,大多數情況下,標準中采用單點控制即可,取樣時間點一般為30~60分鐘,溶出限度通常應為不少于70%~85%。對于溶出較慢或水溶性差的藥物(BCS 2類),根據療效和/或副作用的特點,可采用兩點檢測法進行藥品的溶出控制,**點在15分鐘,規定一個溶出度范圍,第二個取樣點(30、45或60分鐘)時的溶出量應不低于85%。藥品在整個有效期內均應符合制定的溶出度標準。如果制劑的溶出特性在儲存或運輸過程中發生改變,應根據該樣品與關鍵臨床試驗(或生物等效試驗)用樣品的生物等效性結果,決定是否變更溶出度標準。為了保證放大生產產品以及上市后發生變更的產品持續的批間生物等效性,其溶出曲線應與獲得審批的生物等效批次或關鍵臨床試驗批次的溶出曲線一致。#p#分頁標題#e#
(二)仿制藥溶出度標準的建立
根據參比制劑是否有公開的溶出度試驗方法,可考慮以下三種仿制藥溶出度標準建立方法:
1.中G藥典或G家藥品標準收載溶出度試驗方法的品種 建議采用中G藥典或G家藥品標準收載的方法。應取受試和參比制劑各12片(粒),按照15分鐘或更短時間間隔取樣,進行溶出曲線的比較。必要時,應進行不同溶出介質或試驗條件下的溶出度試驗,并根據試驗數據確定**終的溶出度標準。復方制劑的G家藥品標準未對所有成分進行溶出度測定時,應對所有成分進行溶出研究并確定在標準中是否對所有成分進行溶出度檢查。
2.G家藥品標準未收載溶出度試驗方法但可獲得參考方法的品種
建議采用G外藥典或參比制劑的溶出度測定方法,應取受試和參比制劑各12片(粒),按照15分鐘或更短時間間隔取樣,進行溶出曲線的比較。必要時,應進行不同溶出介質或試驗條件下的溶出度試驗,并根據試驗數據確定**終的溶出度標準。
3.缺乏可參考的溶出度試驗方法的品種
建議在不同溶出度試驗條件下,進行受試制劑和參比制劑溶出曲線的比較研究。試驗條件可包括不同的溶出介質(pH值1.0∼6.8)、加入或不加表面活性劑、不同的溶出裝臵和不同的轉速。應根據生物等效性結果和其他數據制定溶出度標準。
(三)特例-兩點溶出試驗
對于水溶性較差的藥物(如卡馬西平),為保證藥品的體內行為,建議采用兩個時間點的溶出度試驗或溶出曲線法進行質量控制。
(四)繪圖或效應面法
繪圖法是確定關鍵生產變量(CMV)與體外溶出曲線及體內生物利用度數據效應面之間相關性關系的過程。關鍵生產變量包括可顯著影響制劑體外溶出度的制劑處方組成、工藝、設備、原材料和方法的改變(Skelly 1990, Shah 1992)。該方法的目的是制定科學、合理的溶出度標準,保證符合標準的藥品具有生物等效性。已有幾種試驗設計可用于研究CMV對藥品性能的影響。其中一種方法如下:
1.采用不同的關鍵生產參數制備兩個或更多的樣品制劑,并研究其體外溶出特征;
2.采用一定受試者(比如n≥12),對具有**快和**慢溶出度特征的樣品與參比制劑或擬上市樣品進行體內對比試驗;
3.測定這些受試樣品的生物利用度及體內外關系。具有極端溶出度特征的樣品亦稱為邊緣產品。如果發現具有極端溶出度特征的樣品與參比制劑或擬上市樣品具有生物等效性,則將來生產的溶出特征符合規定的產品可保持生物等效。通過此項研究,可以為溶出度限度的合理設定提供依據。
采用繪圖方法確定的藥品溶出度標準可更好地確保穩定的藥品質量和性能。根據研究的樣品數,繪圖研究可提供體內外相關性信息和/或體內數據與體外數據間的關系。(五)體內-體外相關性
對于高溶解性(BCS 1類和3類)藥物,采用常規輔料和生產技術制備的普通口服固體制劑,建立體內外相關性較為困難。對于水溶性差(如BCS 2類)的藥物,有可能建立體內外相關性。
對于一種藥物制劑,如果能夠建立其體內體外相關性,則采用溶出度試驗來預測藥物制劑體內行為的質控意義就會顯著提高,通過體外溶出度測定就可區分合格和不合格的產品。溶出度合格的產品應是體內生物等效的產品,而不合格的產品則不具有生物等效性。為建立藥品的體內體外相關性,應該**少得到三批具有不同體內或體外溶出行為的樣品數據。如果這些樣品的體內行為不同,可以通過調整體外溶出度試驗的條件,使體外的數據能夠反映體內行為的變化,從而建立體外-體內相關性。如果這些批次的體內行為沒有差異,但體外溶出特性有差別,則可能需要通過調整溶出度試驗條件使其體外測定結果相同。大多情況下,體外溶出度試驗比體內試驗具有更高的靈敏性和更強的區分能力。因此,從質量保證的角度,建議采用較靈敏的體外溶出度試驗方法,這樣可以在藥品的體內行為受到影響之前及時發現藥品質量的變動。#p#分頁標題#e#
(六)溶出度標準的驗證和確認
一種體外檢驗方法的驗證,可能需要通過體內研究來確認。在此情況下,應選用處方相同但關鍵工藝參數不同的樣品開展研究。制備兩批體外溶出行為不同的樣品(繪圖法),進行體內測試。如果兩批樣品顯示了不同的體內行為,則可認為該體外溶出度試驗方法得到了驗證。但如果兩批樣品的體內行為沒有
差異,則可認為在繪圖法中得到的溶出度數據作為溶出限度的 合理性得到確認。總之,需要對溶出度標準進行驗證或者確認。
五、溶出曲線的比較
藥品上市后發生較小變更時,采用單點溶出度試驗可能就足以確認其是否未改變藥品的質量和性能。發生較大變更時,則推薦對變更前后產品在相同的溶出條件下進行溶出曲線比較。在整體溶出曲線相似以及每一采樣時間點溶出度相似時,可認為兩者溶出行為相似。可采用非模型依賴法或模型依賴方法進行溶出曲線的比較。
(一)非模型依賴法
1. 非模型依賴的相似因子法
采用差異因子(f1)或相似因子(f2)來比較溶出曲線是一種簡單的非模型依賴方法。差異因子(f1)法是計算兩條溶出曲線在每一時間點的差異(%),是衡量兩條曲線相對偏差的參數,計算公式如下:
其中n為取樣時間點個數,Rt為參比樣品(或變更前樣品)在t時刻的溶出度值,Tt為試驗批次(變更后樣品)在t時刻的溶出度值。相似因子(f2)是衡量兩條溶出曲線相似度的參數,計算公式如下:
其中n為取樣時間點個數,Rt為參比樣品(或變更前樣品)在t時刻的溶出度值,Tt為試驗批次(變更后樣品)在t時刻的溶出度值。
差異因子和相似因子的具體測定步驟如下:
(1)分別取受試(變更后)和參比樣品(變更前)各12片(粒),測定其溶出曲線。
(2)取兩條曲線上各時間點的平均溶出度值,根據上述公式計算差異因子(f1)或相似因子(f2)。
(3)f1值越接近0,f2值越接近100,則認為兩條曲線相似。一般情況下,f1值小于15或f2值高于50,可認為兩條曲線具有相似性,受試(變更后)與參比產品(變更前)具有等效性。
這種非模型依賴方法**適合于三**四個或更多取樣點的溶出曲線比較,采用本方法時應滿足下列條件:
• 應在完全相同的條件下對受試和參比樣品的溶出曲線進行測定。兩條曲線的取樣點應相同(如15、30、45、60分鐘)。應采用變更前生產的**近一批產品作為參比樣品。
•藥物溶出量超過85%的取樣點不超過一個。
• **個取樣時間點(如15 分鐘)的溶出量相對標準偏差不得超過20%,其余取樣時間點的溶出量相對標準偏差不得超過10%。#p#分頁標題#e#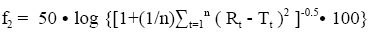
• 當受試制劑和參比制劑在15分鐘內的溶出量≧85%時,可以認為兩者溶出行為相似,無需進行f2的比較。
2.非模型依賴多變量臵信區間法
對于批內溶出量相對標準偏差大于15%的藥品,可能更適于采用非模型依賴多變量臵信區間方法進行溶出曲線比較。建議按照下列步驟進行:
(1)測定參比樣品溶出量的批間差異,然后以此為依據確定多變量統計矩(Multivariate statistical distance,MSD)的相似性限度。
(2)確定受試和參比樣品平均溶出量的多變量統計矩。
(3)確定受試和參比樣品實測溶出量多變量統計矩的90%臵信區間。
(4)如果受試樣品的臵信區間上限小于或等于參比樣品的相似性限度,可認為兩個批次的樣品具有相似性。
(二)模型依賴法
已有一些擬合溶出度曲線的數學模型的報道。采用這些模型比較溶出度曲線,建議采取以下步驟:
1.選擇**適當的模型比較擬合標準批次、改變前批次和已批準受試批次的溶出曲線。建議采用不多于三個參數的模型(如線性模型、二次模型、對數模型、概率模型和威布爾模型)。
2.根據各樣品的溶出數據繪制溶出曲線并采用**合適的模型擬合。
3.根據參比樣品擬合模型的參數變異性,設定相似區間。
4.計算受試和參比樣品擬合模型參數的MSD。
5.確定受試與參比樣品間溶出差異的90%臵信區間。
6.比較臵信區間與相似性限度。如果臵信區間落在相似性限度內,可認為受試與參比樣品具有相似的溶出曲線。
六、普通口服固體制劑上市后變更的溶出度研究
在《已上市化學藥品變更研究技術指導原則》中,對于普通口服固體制劑批準上市后的變更,根據變更程度,已經對研究驗證內容及申報資料要求進行了闡述。根據變更程度和藥物的生物藥劑學特點,指導原則中提出了相應的體外溶出度試驗要求以及體內生物等效性研究要求。根據藥物的治療窗、溶解性及滲透性的不同,對體外溶出度試驗條件的要求也不同。對于該指導原則中未提及的處方變更,建議在多種介質中進行溶出比較試驗。對于生產場所的變更、放大設備變更和較小的工藝變更,溶出度試驗應足以確認產品質量和性能是否有改變。該指導原則推薦采用非模型依賴相似因子(f2)方法進行溶出度的對比研究,以確認變更前后產品質量是否一致。
七、體內生物等效性試驗的豁免
對于多規格藥品,溶出度比較試驗還可用于申請小劑量規格藥品體內生物等效性試驗的豁免。
當藥物具有線性動力學的特點且不同劑量規格藥品處方組成比例相似時,可對**大劑量規格的藥品開展生物等效性研究,#p#分頁標題#e#
基于充分的溶出度比較試驗,可以豁免小劑量規格藥品的體內研究。處方組成比例相似性的判定可參見《已上市化學藥品變更研究技術指導原則》中“變更藥品處方中已有藥用要求的輔料”項下的相應內容。新增規格藥品生物等效豁免與否,取決于新增規格與原進行了關鍵生物等效性試驗規格藥品的溶出曲線比較結果及處方組成的相似性。溶出曲線的比較應采用本指導原則第五部分項下所述的方法進行測定和評價。
附錄溶出度試驗條件
一、儀器
籃法和槳法是目前**常用的溶出度測定方法,具有裝臵簡單、耐用及標準化的特點,適用于大部分口服固體制劑。中G藥典收載的小杯法可視為槳法,適用于低劑量規格固體制劑的溶出試驗。
通常應選用中G藥典收載的方法,如籃法和槳法,必要時可采用往復筒法或流通池法進行體外溶出度試驗。
對于某些藥品或劑型,必須采用專門的溶出裝臵時,應進行詳細的論證,充分評價其必要性和可行性。shou先應考慮對法定方法進行適當的改裝,確定是否能滿足質量控制的要求。隨著對生命科學及藥劑學的深入研究,可能需要對溶出度方法及試驗條件進行改進,以保證獲得更好的體內外相關性。
二、溶出介質
(一)溶出介質的選擇
溶出度試驗應盡可能在生理條件下進行,這樣可以從藥品體內行為的角度,更好地理解體外溶出數據。但常規的溶出度試驗 條件不需要與胃腸環境嚴格一致,應根據藥物的理化性質和口服 給藥后可能的暴露條件確定適當的介質。
溶出介質的體積一般為500、900或1000 mL,溶出介質的體積**好能滿足漏槽條件,一般應采用pH值1.2∼6.8的水性介質。可采用不含酶的pH 1.2、6.8的溶出介質作為人工胃液和人工腸液。特殊情況下,可采用高pH的溶出介質,但一般不應超過pH 8.0。
有研究表明,膠囊制劑在貯存過程中,由于明膠的交聯作用可能會形成膜殼,因此可能需要在介質中加入胃蛋白酶或胰酶,以促使藥物的溶出。但應根據具體情況考慮是否在人工胃液或人工腸液中加入酶,并充分證明其合理性。
另外,盡量不采用水作為溶出介質,因為其pH值和表面張力可能隨水的來源不同而不同,且在試驗過程中也可能由于藥物、輔料的影響而有所改變。對于不溶于水或難溶于水的藥物,可考慮在溶出介質中加入十二烷基硫酸鈉或其他適當的表面活性劑,但需充分論證加入的必要性和加入量的合理性。另外,由于表面活性劑的質量可能存在明顯差異,應注意不同質量的表面活性劑對試驗結果帶來的顯著影響。使用標準化的或高純度的表面活性劑可避免上述影響。
不建議在溶出介質中使用有機溶劑。
某些藥物制劑和組分對溶出介質中溶解的空氣較為敏感,因此需要進行脫氣處理。
(二)溶出介質的配制
表 1 溶出介質
pH值 1.0?2.2 3.8 、4.0 4.5?5.8 6.8?8.0
#p#分頁標題#e#
溶出介質 鹽酸溶液 醋酸鹽緩沖液 醋酸鹽或磷酸鹽緩沖液 磷酸鹽緩沖液
上述各溶出介質的組成和配制詳述如下: 1.鹽酸溶液
取下表中規定量的鹽酸,加水稀釋**1000mL,搖勻,即得。
表2 鹽酸溶液的配制
鹽酸 (mL)
9.00
7.65
6.05
4.79
3.73
2.92
2.34
1.84
1.46
1.17
0.92
0.70
2.醋酸鹽緩沖液
2mol/L醋酸溶液:取120.0g(114mL)冰醋酸用水稀釋**1000mL,即得。
取下表中規定物質的取樣量,加水溶解并稀釋**1000mL,搖勻,即得。
表3 醋酸鹽緩沖溶液的配制
pH值 醋酸鈉取樣量(g) 2mol/L醋酸溶液取樣量
(ml)
3.8 0.67 22.6
4.0 1.22 20.5
4.5 2.99 14.0
5.5 5.98 3.0
5.8 6.23 2.1
3.磷酸鹽緩沖液
0.2mol/L磷酸二氫鉀溶液:取27.22g磷酸二氫鉀,用水溶解并稀釋**1000mL。
0.2mol/L氫氧化鈉溶液:取8.00g氫氧化鈉,用水溶解并稀釋**1000mL。
取250mL 0.2mol/L磷酸二氫鉀溶液與下表中規定量的0.2mol/L氫氧化鈉溶液混合后,再加水稀釋**1000mL,搖勻,即得。#p#分頁標題#e#
表4 磷酸鹽緩沖液
pH值 4.5 5.5
9.0
7.0 5.8 18.0 7.2 6.0 28.0 7.4 6.2 40.5 7.6 6.4 58.0 7.8 6.6 82.0 8.0 0.2mol/L氫氧化鈉溶液(mL) 0 pH值 6.8
0.2mol/L氫氧化鈉溶液(mL) 112.0 145.5 173.5 195.5 212.0 222.5 230.5 以上為推薦采用的溶出介質配制方法,如有特殊情況,研究者也可根據研究結果采用其他的溶出介質以及相應的配制方法。
三、溫度、轉速及其他
所有普通口服制劑的溶出試驗均應在37±0.5℃的條件下進行。
溶出度試驗過程中應采用較緩和的轉速,使溶出方法具有更 好的區分能力。一般情況下籃法的轉速為50∼100 轉/分鐘;槳 法的轉速為50∼75轉/分鐘。
對于容易產生漂浮的片劑或膠囊,在建立溶出度測定方法時建議采用籃法。當必須采用槳法時,可使用沉降籃或其他適當的沉降裝臵。
參考文獻
1.Amidon, G. L., H. Lennernas, V. P. Shah, and J. R. Crison, 1995, “A Theoretical Basis For a Biopharmaceutic Drug Classification: The Correlation of In Vitro Drug ProductDissolution and In Vivo Bioavailability,” Pharmaceutical Research, 2:413-420.
2.FDA, 1995, Center for Drug Evaluation and Research, Guidance for Industry: ImmediateRelease Solid Oral Dosage Forms. Scale-up and Post-Approval Changes: Chemistry,Manufacturing and Controls, In Vitro Dissolution Testing, and In Vivo Bioequivalence Documentation [SUPAC-IR], November 1995.
3.Meyer, M. C., A. B. Straughn, E. J. Jarvi, G. C. Wood, F. R. Pelsor, and V. P. Shah, 1992,“The Bioequivalence of Carbamazepine Tablets with a History of Clinical Failures,”Pharmaceutical Research, 9:1612-1616.
4.Moore, J. W. and H. H. Flanner, 1996,“Mathematical Comparison of Dissolution Profiles,”Pharmaceutical Technology, 20 (6):64-74.
5.Shah, V. P., et al., 1989, “In Vitro Dissolution Profile of Water Insoluble Drug Dosage Forms inthe Presence of Surfactants,”Pharmaceutical Research, 6:612-618.
6.Shah, V. P., et al., 1992,“Influence of Higher Rate ofAgitationon Release Patterns of Immediate Release Drug Products,”Journal of Pharmaceutical Science, 81:500-503.
7.Shah, V. P., J. P. Skelly, W. H. Barr, H. Malinowski, and G. L. Amidon, 1992,“Scale-up of Controlled Release Products
–PreliminaryConsiderations,”Pharmaceutical Technology, 16(5):35-40.
8.Shah, V. P., et al., 1995,“In Vivo Dissolution of Sparingly Water Soluble Drug Dosage Forms,” International Journal of Pharmaceutics, 125:99-106.
9.Siewert, M., 1995,“FIP Guidelines for Dissolution Testing of Solid Oral Products,”Pharm.Ind. 57:362-369.
10. Skelly, J. P., G. L. Amidon, W. H. Barr, L. Z. Benet, J. E. Carter, J. R. Robinson, V. P. Shah, and A. Yacobi, 1990,“In Vitro and In Vivo Testing and Correlation for Oral Controlled/Modified-Release Dosage Forms,”Pharmaceutical Research, 7:975-982.#p#分頁標題#e#
11. G家食品藥品監督管理局,已上市化學藥品變更研究的技術指導原則(一),2008.
12.中G藥典2010版二部附錄,溶出度測定法。
13. British Pharmacopeia 2012,Dissolution test for tablets and capsules.