摘要 目的:建立能夠區分西咪替丁片劑中不同晶型的溶出度試驗法。方法:采用相似因子作為評價指標,系統地研究在不同溶出度條件下,不同晶型的溶出特性。結果:以pH 6.8磷酸鹽緩沖液900 mL為溶出介質,轉速為50 r·min。在該溶出度試驗法中,西咪替丁A晶型片劑可以在25 min內全部溶出,而西咪替丁B晶型在25 min內溶出量僅在40%~50%。結論:本方法可有效區分不同晶型西咪替丁片,為我G西咪替丁片的質量控制提供參考。
關鍵詞:溶出度試驗;西咪替丁片;晶型
中圖分類號:R917 文獻標識碼:A 文章編號:0254-1793(2008)0-0-0 -11,222
The application of dissolution test on distinguishing the
polymorphism A and B of cimetidine tablets
LIU Qian1,2, WU Xiao-hu2, CHEN Gui-liang2
(1.Shanghai Institute of Pharmaceutical Industry, Shanghai 200040, China
2.Shanghai Institute for Food and Drug Control, Shanghai 201203,China)
Abstract Objective: To establish a dissolution method to distinguish polymorphism A and B of cimetidine tablets. Method:The factor similitude was adopted as an index, different dissolution methods were studied. Results: 900 mL of pH 6.8 Phosphate buffer was used as dissolution medium and apparatus was operated at the rate of 50 r·min. In this dissolution method, cimetidine tablets with polymorphism A could be dissolved completely, and cimetidine tablets with polymorphism B could only be dissolved to 40%~50%. Conclusion: The method is accurate and convenient,and can be used to distinguish form A and B of cimetidine tablets.
Key words: dissolution method; cimetidine tablets; polymorphism
西咪替丁是組胺H2 受體拮抗劑, 臨床上廣泛用于治療消化道潰瘍。西咪替丁存在多晶型, 到目前為止,西咪替丁已知的晶型共有7種,以無水物形式存在的A、B、C、D 4種晶型和以一水合物形式存在的M1、M2、M3 3種晶型。以水合物形式存在的3種晶型其熱穩定性較差,室溫條件放置數月,M1晶型可脫水轉變為A晶型;M2晶型加熱90 ℃可轉變為C晶型;M3晶型在室溫下即可轉變為D晶型[1]。基于此,對于西咪替丁晶型的研究,主要集中在A、B、C、D這4種。
據報道A 晶型的生物有效性**佳[2] 。Shogo Sudo等人[3]比較了水、異丙醇、水-異丙醇中A晶和B晶的溶解性質,3種溶劑體系中,A晶較B晶均表現出更好的溶解性。Hiromasa Kokubo等[2]證實了西咪替丁在老鼠體內的生物利用度是A晶>B晶>D晶>C晶的順序。由于西咪替丁不同晶型的溶解性差異給制劑的溶出度和生物利用度造成了差別,因此需要對西咪替丁的晶型進行控制。尹華等[4]在2001年分別采用差示掃描量熱法(DSC)、紅外光普法(IR)以及X射線衍射法(X-ray)對西咪替丁原料A晶型、B晶型進行研究,研究表明采用上述檢測手段均可以對西咪替丁原料晶型進行定性鑒別及質量控制,其中DSC可以粗略地對西咪替丁原料混合晶型定量,在實際應用中發現各廠家生產工藝不同,晶型亦不同。此外張雅軍[5]通過衰減全反射傅里葉變換紅外光譜法建立了可以定量測定西咪替丁原料中A晶型的方法。
為了考察G內西咪替丁制劑的晶型狀況, 筆者分別采用DSC 法及X-ray 法對西咪替丁片劑中晶型進行檢查,發現G內廠家大部分為西咪替丁B晶型,僅有1個廠家的西咪替丁為A 晶型[6]。目前中G藥典等四G藥典
[7-10]均未對西咪替丁片晶型采用DSC 法及X-ray 法進行控制。在中G藥典2005年版二部中制定了西咪替丁片的溶出度檢查方法[7],但該法不具有區分晶型的功能(不同廠家的產品均能在5~8 min內完全溶出),故此需要建立能評價西咪替丁不同晶型制劑質量的體外溶出度方法。
本文擬采用美GFDA推薦的相似因子法[11]評價試驗樣品 (B晶型片劑)與對照樣品(A晶型片劑)的體外溶出度差異,選擇使試驗樣品(B晶型片劑)與對照樣品(A晶型片劑)相似因子f2
丁A、B晶型片劑。
1 相似因子法介紹
相似因子法基本原理:基于生物等效性的基本假設進行體外溶出度的等效性評價。相似因子法計算的基本假設是試驗樣品與對照樣品的累積溶出度差的平方和**小,即相似度**好說明試驗樣品與對照樣品是一致的。本文采用相反的思路,使用累積溶出度差的平方和**大為指標:由于已知試驗樣品(B晶型片劑)與對照樣品(A晶型片劑)雖然都是西咪替丁化合物,但卻不是相同晶型,因此其累積溶出度差的平方和應**大,相似因子應**小。基本公式:
① 計算不同時間的累積溶出度(Yt);
n[11]**小的溶出度條件,以區分西咪替
② 計算某一時間點的平均溶出度(Ynt): Ynt=(1/n)?ynti
i?1式中Ynt可為某一時間點試驗樣品的平均溶出度 (YTt)或某一時間點對照樣品的平均溶出度 (YRt);
n
③計算試驗樣品與對照樣品的平均溶出度的方差和(Q): Q=?(yRt?yTt)
i?12
④計算相似因子(f2): f2=50×lg[(1+Q/n)
2 儀器與試藥 -0.5×100]
德G艾維卡ERWEKA自動溶出儀;島津2550可見紫外分光光度計。
2西咪替丁對照品(批號031103,含量為99.8%)由中G藥品生物制品檢定所提供;西咪替丁A、B晶型原料藥為經重結晶制得[1];取西咪替丁A、B晶型原料藥與輔料(主要為淀粉、硬脂酸鎂、靛藍著色劑等)適量,按處方量的配比分別制成西咪替丁A晶型片(作為本實驗的對照樣品)、B晶型片(試驗樣品) (規格:每片0.4 g);其它試驗樣品:西咪替丁片分別來自廠家Ⅰ(規格:每片0.4 g;批號06040512;采用DSC法確認為A晶型)、廠家Ⅱ(規格:每片0.2 g;批號060707;采用DSC法確認為B晶型)、廠家Ⅲ(規格:每片0.2 g;批號070108;采用DSC法確認為B晶型),均為市場抽驗樣品;所用試劑均為分析純,水為純凈水。#p#分頁標題#e#
3 試驗方法
3.1 方法學驗證
3.1.1 線性試驗
取西咪替丁對照品適量,分別以0.01 mol·L-1鹽酸溶液,pH 4.0醋酸鹽緩沖液,pH 6.8磷酸鹽緩沖液及水為溶劑,溶解并稀釋制成含西咪替丁的濃度約為0.8-9.6 µg·mL的一系列溶液,在200-300nm范圍內的**大吸收波長處進行測定,以吸收度A對溶液濃度C(µg·mL)作線性回歸,測得的吸光度與溶液濃度成良好的線性關系,結果見表1。
3.1.2 輔料干擾
取西咪替丁片劑的輔料約一片量,分別以0.01 mol·L-1鹽酸溶液,pH 4.0醋酸鹽緩沖液,pH 6.8磷酸鹽緩沖液及水為溶劑,模擬溶出度測定時的濃度,分別制備溶液,在218nm處西咪替丁的**大吸收波長處進行紫外測定,計算輔料的吸收值相對于西咪替丁吸收值的百分量,結果表明輔料對此測定無干擾,見表1。
3.1.3精密度
取“3.1.1”項下四種溶劑(0.01 mol·L-1鹽酸溶液,pH 4.0醋酸鹽緩沖液,pH 6.8磷酸鹽緩沖液及水)配制的線性試驗用溶液為100%濃度點(約為8µg·mL)的溶液在218nm的**大吸收波長處重復測定6次,根據吸光度值計算RSD值,結果見表1。
3.1.4穩定性
取“3.1.1”項下四種溶劑(0.01 mol·L-1鹽酸溶液,pH 4.0醋酸鹽緩沖液,pH 6.8磷酸鹽緩沖液及水)配制的線性試驗用溶液為100%濃度點(約為8µg·mL)的溶液,在24小時內間隔一定時間,在218nm的**大吸收波長處測定,根據吸光度值計算RSD值,結果見表1。
表1 西咪替丁在四種溶劑中的方法學驗證結果
Tab 1 The validation results of cimetidine in four solvents
方法學 validation
線性試驗
linearity
-1-1-1-10.01 mol·L-1鹽酸溶液 pH 4.0醋酸鹽緩沖液 pH 6.8磷酸鹽緩沖液 0.8390~10.07 0.8115~9.738 0.8275~9.930 水 0.8050~9.660 濃度范圍 Con. range(µg·mL-1) 線性方程 A=0.1782C+0.0053 linearity equation (n=7) A=0.1485C+0.0068 A=0.1625C+0.0057 A=0.1724C+0.0048 3輔料干擾 精密度 precision 穩定性 stability
相關系數 correlation A輔料/A西咪替丁 RSD (%) RSD (%)
r =0.9999 r=0.9999 r=0.9999 r=0.9999
exipient interference Aexipient/Acimetidine (%)
0.2 0.15 0.21
0.3 0.18 0.28
0.2 0.17 0.25
0.2 0.22 0.38
3.2溶出條件的選擇
3.2.1 轉速的選擇 以pH 6.8磷酸鹽緩沖液作為溶出介質,考察了不同轉速對自制的西咪替丁A晶型片、B晶型片溶出的影響,選擇能區分兩者的轉速,結果見表2。試驗結果表明,轉速與溶出速度呈正比例關系,在100 r·min、75 r·min轉速下,2種晶型不能完全區分,而在50 r·min轉速下于25 min時A晶型片基本溶出,而B晶型片溶出仍在繼續增加中。因此中G藥典規定的轉速100 r·min,在條件上比較劇烈,不能區分晶型溶出,故本文選擇轉速為50 r·min。
表2 不同轉速條件下的溶出量(%)
Tab 2 The percentage of cimetidine tablets dissolution under different rates (%)
轉速

100
-1-1-1
-1
-1
A B A B A B
50.0 52.3 52.3 51.1 10.0 8.5
85.0 86.3 84.6 85.1 16.0 12.3
99.2 99.6 98.6 99.7 49.8 21.0
99.5 99.8 99.6 99.4 69.7 29.4
100.1 99.6 99.7 100.1 87.6 35.7
99.6 99.7 99.6 99.8 98.9 47.4
99.8 98.6 99.8 99.7 100.1 53.7
100.2 100.1 99.6 99.8 100.5 58.0
75
50
3.2.2溶出介質的選擇 選擇4種有代表性的溶出介質(0.01 mol·L-1鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水)對A晶型片、B晶型片的溶出情況做一考察。本文采用美GFDA推薦的相似因子法評價A晶型片和B晶型片(自制,規格:0.4g)的體外溶出度差異,據此評價該介質是否適合區分A、B晶型片劑。從相似因子法的評價角度[11]看來,當A、B晶型片劑的f2≥50時,表明此溶出介質對于晶型的區分度差。故確定以f2≤50且**小值的介質作為實驗用溶出介質。從表3中可以看出f2**小的是pH 6.8磷酸鹽緩沖液,僅為18.3,因此確定采用該溶液作為區分西咪替丁晶型溶出的介質。
表3 4種溶出介質下自制的西咪替丁A、B晶型片的相似因子計算結果
Tab 3 The similarity factor (f2) results of prepared cimetidine polymorphism A and B under 4 dissolution mediums
溶出介質 dissolution medium
方差和 相似因子(f2)
the sum of variance similarity factor (f2)
40.01 mol·L-1鹽酸溶液
0.01 mol·L-1 HCl
pH 4.0醋酸鹽緩沖液
pH4.0 acetate buffer
pH 6.8磷酸鹽緩沖液
pH 6.8 phosphate buffer
水
water 4316.9 4029.7 14842.4 1496.6 31.7 32.4 18.3 43.1
3.3 溶出度測定方法 取試驗樣品,照中G藥典溶出度測定法(附錄Ⅹ C**法)[7],以pH 6.8磷酸鹽緩沖液900 mL為溶出介質,轉速為50 r·min,依法操作,經25 min,取溶液約10 mL,濾過,精密量取續濾液適量,用pH 6.8磷酸鹽緩沖液稀釋制成每1 mL 中約含5~10 μg的溶液,作為供試品溶液。精密稱取西咪替丁對照品約10 mg,置50 mL量瓶中,用鹽酸溶液(0.9→1000)稀釋**刻度(200 μg·mL-1),再用pH 6.8磷酸鹽緩沖液制成每1 mL中含5~10 μg的溶液,作為對照溶液。照紫外分光光度法(中G藥典2005年版二部 附錄Ⅳ A)在218 nm波長處測定吸收度,分別計算出每片的溶出量。限度為標示量的75%,應符合規定。#p#分頁標題#e#
4 試驗樣品的溶出度測定結果
分別取廠家Ⅰ(A晶型片劑)、廠家Ⅱ(B晶型片劑)、廠家Ⅲ(B晶型片劑)的試驗樣品各6片,按“3.3”項下的溶出條件試驗,結果見圖1。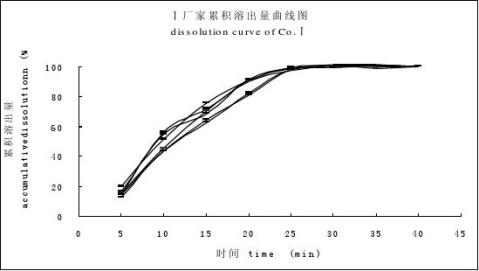
-1
A
5
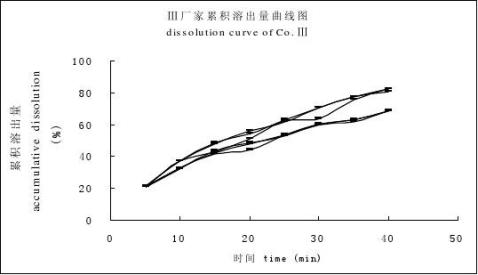
圖1 廠家Ⅰ(A)、廠家Ⅱ(B)、廠家Ⅲ(C)累積溶出百分率曲線圖
Fig 1 The dissolution curves of cimetidine tablets from different companies, Co.Ⅰ (A), Co.Ⅱ (B), Co.Ⅲ(C) 5 討論
5.1本實驗分別考察了在四種溶劑中(0.01 mol·L-1鹽酸溶液、pH 4.0醋酸鹽緩沖液、pH 6.8磷酸鹽緩沖液、水)西咪替丁濃度與吸光度的線性關系,精密度以及穩定性及輔料干擾情況。實驗結果表明,四種溶劑中西咪替丁在1~10μg/mL的濃度范圍內吸收度與濃度均成良好的線性關系;24小時內西咪替丁溶液是穩定的;輔料在218nm處的吸光度小于西咪替丁吸光度值的0.4%,表明輔料對此測定無干擾。
5.2 本文建立溶出度條件的出發點是有效區分西咪替丁片劑中多晶型,因此制定的條件相對于中G藥典而 6
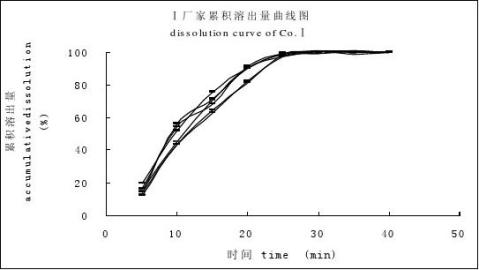
言條件比較嚴格,從廠家Ⅰ、廠家Ⅱ、廠家Ⅲ 3批試驗樣品中可以看出由于晶型的差異導致在25 min時廠家Ⅱ和廠家Ⅲ的試驗樣品的溶出量僅為40%~50%左右,而廠家Ⅰ試驗樣品的溶出量達到98%以上。
5.3 三個廠家來源的西咪替丁試驗樣品的累積溶出度存在差異,而中G藥典中沒有過多地體現對于藥品內在質量控制上,不能夠區分出這種差異。類似于西咪替丁制劑這種晶型間存在生物利用度差異的藥物有很多,中G藥典對于晶型的控制主要針對原料藥,但由原料藥通過一定的制藥工藝后制備得到的制劑是否還是有效晶型就不得而知了。本文提出采用溶出度檢查的方式來控制晶型,是考慮到:固體藥品制劑的體外溶出度數據是評價一種藥物制劑不同品種、不同廠家產品、不同批次間質量的重要數據。體外溶出度在某種程度上與體內生物利用度呈現一定的相關性,往往是從其體外溶出度數據也可估計其藥物動力學和藥物生物利用度的特點。
5.4 本文采用相似因子為指標建立的溶出度試驗方法,能有效區分不同晶型的西咪替丁片,為中G藥典在有效晶型藥物制劑中的質量控制上控制提供一種思路,也可供溶出度方法建立時參考。
參考文獻
1
2 Hegedus B,Gorog S. The polymorphism of cimetidine. J Pharm Biomed Anal, 1985, 3 (4): 303-313. Hiromasa K., Kazuhiro M.,Toshimasa I.,et.al. Bioavailability and inhibitory effect for stress ulcer of cimetidine
polymorphs in rats.Int J Pharm, 1987, 35: 181-183.
3 Shogo S., Katsutoshi S., Yoshio H. et al, Solubilities and crystallization behavior of cimetidine polymorphic forms
A and B. J Chem Eng Jpn, 1991, 24 (2) 237-242.
4 YIN Hua(尹華),YANGLa-hu(楊臘虎),YU Ru-ying(俞如英),et al.Determination of cimetidine polymorphism(西
咪替丁的晶型研究).Chin J Pharm Anal(藥物分析雜志),2001,21(1):39
5 ZHANG Ya-jun(張雅軍),TIAN Song-jiu(田頌九).Determination of cimetidine polymorphic form A by
ATR-FTIR(衰減全反射傅里葉變換紅外光譜法定量分析西咪替丁A晶型的含量).Chin Pharm J(中G藥學雜志),2005,40(20):1587
6 WU Xiao-hu (吳小虎), LIU Qian (劉茜), CHEN Gui-liang (陳桂良), et al. Study on the polymorphism of
cimetidine by Powder X-ray Diffraction(X射線粉末衍射法對西咪替丁多晶型的研究). Chin Pharm J (中G藥學雜志),in press.
7
8
9 ChP(中G藥典).2005. Vol Ⅱ(二部):191 USP30-NF25(美G藥典):1752 BP2005(英G藥典):1571
10 JP14(日本藥局方):365
11 XIA Jin-hui(夏錦輝),LIU Chang-xiao(劉昌孝).Statistical evaluation of dissolution of solid pharmaceutical 7